2024年 | プレスリリース?研究成果
炎症を司る分子STINGの活性化機構を完全解明 自己炎症性?神経変性疾患の新規治療戦略
【本学研究者情報】
〇生命科学研究科 教授 田口友彦
研究室ウェブサイト
【発表のポイント】
- STING(注1)経路は、DNAウイルス感染から身体を守る自然免疫経路の1つです。そのSTINGのトランスゴルジネットワーク(TGN)(注2)における活性化分子機構を解明しました。
- STINGがTGNでクラスター化すること、クラスター化がSTINGの活性化に必要なこと、クラスター化にパルミトイル脂質修飾(注3)とゴルジ体コレステロールが必要であることをまとめて明らかにしました。
- 炎症性疾患?神経変性疾患の発症機序の理解、および治療薬の開発につながる成果であり、医学?薬学分野への展開が期待できます。
【概要】
自然免疫は、先天的に備わっている、異物に対する応答機構です。STINGタンパク質は、ヘルペスウイルスなどのDNAウイルスの感染に応答して自然免疫応答、炎症を誘導します。それによってSTING経路はDNAウイルス感染から身体を守っていますが、その一方で、異常な活性化は自己免疫疾患、神経変性疾患、がんなど多様な疾患を引き起こします。これまで、東北大学大学院生命科学研究科の見目悠大学院生、髙橋花乃子大学院生、向井康治朗助教、田口友彦教授および、東海国立大学機構岐阜大学糖鎖生命コア研究所の鈴木健一教授(国立がん研究センター研究所先端バイオイメージング研究分野分野長 併任)らの共同研究グループは、STINGの活性にはパルミトイル化脂質修飾が必要であることを明らかにしてきました。
今回、STINGは、パルミトイル化脂質修飾を介してTGNのコレステロールを含む脂質マイクロドメインで平均20分子以上のクラスターを形成すること、およびSTINGのクラスター形成が自然免疫シグナルの活性化に必要であることが明らかにしました。本研究成果により細胞内コレステロールレベルを制御することがこれら疾患を治療する新しい手段となると期待されます。
本研究成果は2024年1月11日に科学誌Nature Communicationsに掲載されました。
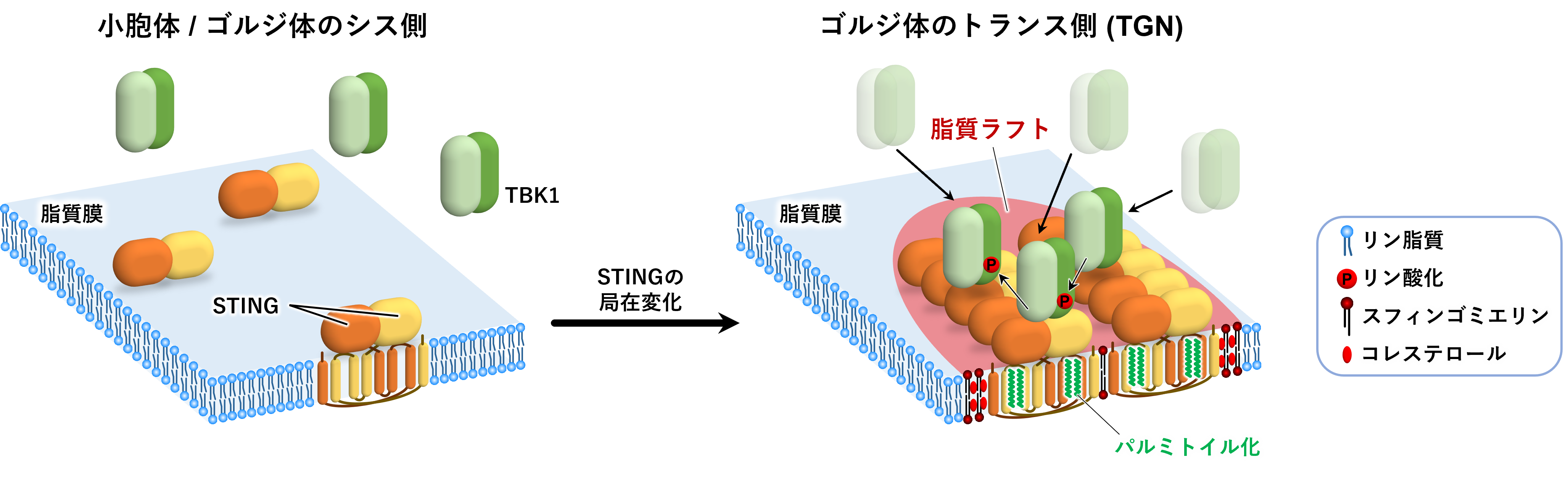
図1. 本研究の概要
小胞体もしくはゴルジ体のシス側に局在するSTINGはクラスターを形成しておらず、TBK1は細胞質に局在しています。一方、TGNに移行したSTINGはパルミトイル化脂質修飾依存的に脂質ラフト上でクラスターを形成します。その結果、TBK1が安定的にSTING上に局在できるようになり、TBK1が活性化します。活性化したTBK1がSTINGなどをリン参加することで自然免疫シグナルを活性化します。
【用語解説】
注1.STING
Stimulator of interferon genesの略。小胞体に局在する4回膜貫通型タンパク質であり、細胞質DNAの出現に応答して自然免疫?炎症応答を惹起します。
注2.トランスゴルジネットワーク(trans-Golgi network:TGN)
ゴルジ体の最も外側に位置する槽(トランス槽)が成熟することによって形成される網目状の膜構造体。
注3.パルミトイル化脂質修飾
タンパク質翻訳後修飾の一種。タンパク質のシステイン残基にパルミチン酸がチオエステル結合で結合します。
問い合わせ先
(研究に関すること)
東北大学大学院生命科学研究科
教授 田口友彦
TEL: 022-795-6676
Email: tomohiko.taguchi.b8*tohoku.ac.jp(*を@に置き換えてください)
(報道に関すること)
東北大学大学院生命科学研究科広報室
高橋さやか
TEL: 022-217-6193
Email: lifsci-pr*grp.tohoku.ac.jp(*を@に置き換えてください)
